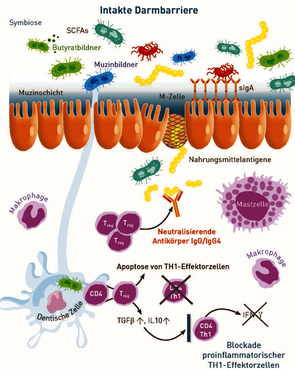
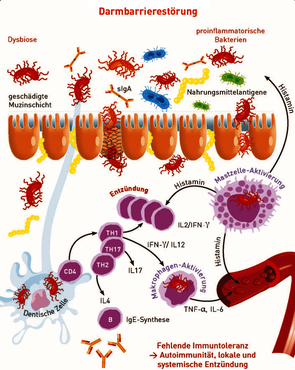
Darmbakterien tragen nicht nur zur Eliminierung von Krankheitserregern und zur Energieversorgung des Darmepithels bei, sondern sie »schulen« auch permanent die in der Submukosa "stationierten" regulatorischen T-Zellen (Treg), welche für die Immuntoleranz gegenüber körperfremden und körpereigenen Antigenen verantwortlich sind. Daher überrascht es nicht, dass Mikrobiota-Veränderungen nicht nur bei chronisch-entzündlichen Darmerkrankungen, sondern auch bei Allergien, Autoimmunerkrankungen und anderen entzündlichen Erkrankungen beobachtet werden.
Über die Bedeutung einzelner Bakterienspezies für die Immuntoleranz ist wenig bekannt. Da es sich bei der Darmmikrobiota um eine äußerst komplexe Gemeinschaft handelt, in der sich die Bakterien wechselseitig beeinflussen, ist ihre Zusammensetzung und Balance wichtiger als die Menge einzelner Erreger.
Daher sollte es bei der Analyse von Darmbakterien vorrangig um funktionelle Gruppen gehen und weniger um die Quantifizierung der Einzelerreger
Folgende Faktoren beeinflussen die Immuntoleranz:
Im IMD Berlin nutzen wir ein CE-zertifiziertes, standardisiertes Verfahren, den GA-map Dysbiosis-Test (Genetic Analysis AS). Bei diesem Verfahren werden auf verschiedenen taxonomischen Ebenen mehr als 300 Bakterien erfasst und mittels eines validierten Algorithmus ausgewertet.
Das Verfahren beruht nicht auf der konventionellen 16SSequenzierung. Stattdessen wird die 16S-Region der Bakterien-DNA mittels PCR vervielfältigt und anschließend mit spezifischen fluoreszenzmarkierten Sonden nachgewiesen. Das Verfahren hat gegenüber der 16S-Sequenzierung wichtige Vorteile. Die Analyse ist
Die Berechnung des Dysbiose-Index beruht auf Studien zur Festlegung des »Normals«, also des Kernmikrobioms von gesunden Probanden ohne Immunintoleranz-Erkrankungen. Je höher der Dysbiose-Index ist, umso mehr weicht die Probe von der »Normobiose« ab. Diese Abweichung des Gesamtmikrobioms ist aber unabhängig von den Funktionen einzelner Bakterien und oft erst auffällig, wenn der Darm selbst in entzündliche Mitleidenschaft gezogen ist.
Eine verminderte Diversität (Shannon-Index) zeigt, dass die Artenvielfalt der Mikrobiota reduziert ist. Artenreiche Mikrobiota sind weniger anfällig für die Invasion pathogener Erreger, weil die Vielfalt und Redundanz der bakteriellen Stoffwechselprozesse eine bessere Resistenz ermöglicht.
Das erste der drei funktionellen Profile, die im Kopfteil des Befunds ausgegeben werden, sind die butyratbildenden Bakterien. Butyrat ist eine kurzkettige Fettsäure, die durch mikrobielle Fermentation im Dickdarm synthetisiert wird und als »Bremse« von Entzündungsreaktionen wichtig ist. Butyrat ist zudem für die Aufrechterhaltung der Darmbarriere essenziell, da es als Hauptenergiequelle der Darmepithelzellen dient und die Mukusproduktion anregt. Als wichtige Vertreter dieser Gruppe werden Anaerobutyricum hallii, Eubacterium rectale und Faecalibacterium prausnitzii nachgewiesen.
Die Mukosa (Schleimschicht auf den Darmepithelzellen) ist ein wichtiger Teil der Darmbarriere. Eine Störung begünstigt die Kolonisation pathogener Keime und verursacht Entzündungsreaktionen. In das funktionelle Profil gehen Spezies ein, die nachweislich am Erhalt einer intakten Mukosa beteiligt sind. Wichtige Vertreter dieser Gruppe sind Akkermansia muciniphila, Faecalibacterium prausnitzii und Lactobacillus spp..
Neben indirekten Mechanismen wie dem Schleimhautschutz und der Bildung kurzkettiger Fettsäuren, tragen Bakterien auch direkt dazu bei, die Ansiedlung von Pathogenen an die Darmschleimhaut zu verhindern. Mukosa-assoziierte Bakterien blockieren mögliche Bindestellen am Darmepithel, schütten Bacteriocine aus und konkurrieren mit Pathogenen um Nährstoffe. Um die Kolonisationsresistenz einzuschätzen werden Bacteroides spp., Bifidobacterium spp. und Lactobacillus spp. herangezogen.
Immunogene Moleküle (v.a. LPS von der Oberfläche gramnegativer Bakterien) bewirken eine starke Aktivierung von Makrophagen und Mastzellen. Deshalb begünstigen vermehrte LPS-tragende Proteobakterien entzündliche Prozesse, sowohl lokal im Darmgewebe als auch systemisch (v.a. bei gleichzeitig gestörter Darmbarriere). Beides stört die Immuntoleranz und begünstigt entzündliche systemische Erkrankungen auch abseits des Darmes. Als Indikatoren für eine Erhöhung proinflammatorischer Bakterien wird die Gesamtheit der Proteobacteria sowie die Menge von E. coli (unter Mitdetektion von Shigella spp.) herangezogen.
Im Gegensatz zum Dysbiose-Index und zur bakteriellen Diversität, für deren Berechnung alle detektierten Bakterien verwendet werden, gehen in die vier funktionellen Profile nur solche Bakterien ein, für die diese funktionellen Eigenschaften gesichert sind. Im Befund können also durchaus funktionelle Profile auffällig sein, während die Gesamtheit der detektierten Bakterien weitestgehend unauffällig ist.
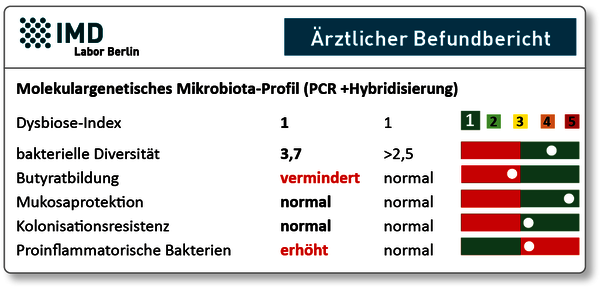
Abb. 3 Befundkopf des Molekulargenetischen Mikrobiotaprofils. Trotz »Normobiose« zeigen die funktionellen Profile signifikante Veränderungen an, welche die Immuntoleranzbildung erheblich beeinträchtigen.
In dem dargestellten Befundbeispiel zeigt sich ein für die Immuntoleranz ungünstiges Profil, auch wenn (noch) keine generelle Dysbiose vorliegt. Daraus lassen sich frühzeitig Therapie- und Präventionsoptionen ableiten. Das Wachstum der Butyratbildner kann durch eine ballaststoffreiche Ernährung (z.B. Akazienfaser, Apfelpektin, Inulin) gefördert werden. Auch können probiotische Bifidobakterien das Wachstum von butyratbildenden Bakterien fördern, da sie das von den Bifidobakterien gebildete Acetat zu Butyrat umwandeln (sogenanntes cross-feeding). Den erhöhten proinflammatorischen Bakterien lässt sich mit einer Darmreinigung z.B. mit Zeolith, Flohsamenschalen oder ätherischen Ölen wie Oregano entgegenwirken. Auch eine zuckerarme Ernährung sowie probiotische Stämme (z.B. Lactobacillus reuteri) sind in der Lage, das bakterielle Gleichgewicht zugunsten einer Reduktion von Proteobakterien zu verschieben.
Für das Molekulargenetische Mikrobiota-Profil benötigen wir zwei zu je 2/3 befüllte Stuhlröhrchen. Um lagerungsbedingte Veränderungen zu vermeiden, sollte der Transport der Stuhlröhrchen ins Labor zeitnah und per Kurier erfolgen. Bitte ordern Sie unseren kostenfreien Kurier unter 030 77001-450.