Parodontitis ist eine chronische Entzündung des Zahnhalteapparates. Auch wenn meist parodontopathogene Bakterien als Auslöser beteiligt sind, ist die Progression des Entzündungsprozesses von der Immunantwort des betroffenen Patienten abhängig. Durch den Entzündungsprozess kommt es zum lokalen Gewebe- und Knochenabbau. Zudem stellt der Entzündungsprozess in der Mundhöhle einen Risiko- und Progressionsfaktor für systemische Entzündungserkrankungen dar (z. B. Arteriosklerose).
Neben den Immunzellen sind auch verschiedene Zytokine und Matrix-Metalloproteinasen in den entzündungsbedingten Gewebeabbau involviert. Schon vor einigen Jahren hat sich das aMMP8 in der Diagnostik etabliert, da es erstmals unmittelbar in der Zahntasche gemessen werden konnte und den lokalen Entzündungsprozess schon in der frühesten Exazerbationsphase wiederspiegelte. In jüngster Zeit zeichnet sich ab, dass das Calprotectin das aMMP8 für diese Fragestellung ersetzen wird.
Calprotectin ist ein Kalzium-bindendes Entzündungsprotein. Es wird vor allem in neutrophilen Granulozyten synthetisiert. Es macht 40 % der in den Granula gespeicherten Mediatoren aus. Nur in geringer Menge wird es in aktivierten Monozyten, in gingivalen Keratozyten (Stratum spinosum) und in entzündlich aktivierten Epithelzellen exprimiert.
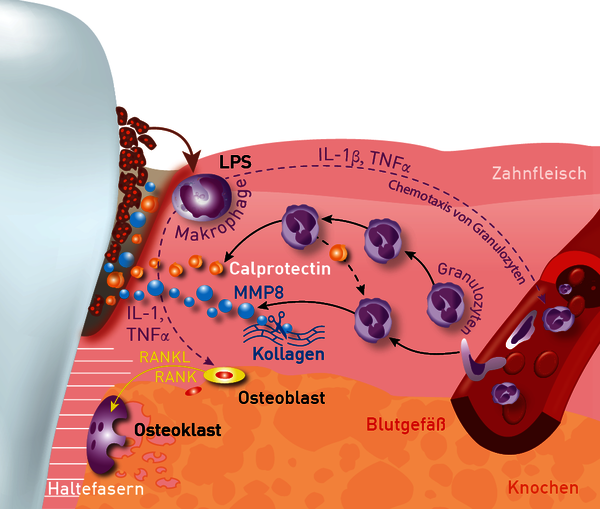
Abb. 1 Die Abbildung zeigt, dass Calprotectin ähnlich wie aMMP8 im paradentikulären Gewebe durch eingewanderte Granulozyten freigesetzt wird und in den Sulkus übertritt. Dort kann Calprotectin durch Einlage eines Papierstreifens gewonnen und im Labor quantifiziert werden.
Die gute Korrelation zwischen Calprotectin-Spiegeln und aktuell ablaufender Gewebedegradation ist dadurch zu begründen, dass Calprotectin selbst durch Umlagerung des Mikrotubulin-Systems für die Migration von Granulozyten ins entzündete Gewebe verantwortlich ist. Die mit dieser »Wanderung« einhergehende Zerstörung von mukosalen Zellbarrieren ist wesentlicher Progressionsfaktor des parodontalen Gewebeabbaus. Daneben hat Calprotectin auch eine eigene antibakterielle und antifungale Wirkung. Diese beruht darauf, dass es die Nährstoffversorgung der Erreger durch kompetitive Bindung von Zinkionen unterbinden kann.
In zahlreichen Studien wurde gezeigt, dass Patienten mit Parodontitis höhere Calprotectin-Spiegel in der Sulkusflüssigkeit (gingival crevicular fluid, GCF) haben als gesunde Probanden. Die Calprotectin-Spiegel korrelieren dabei zum Blutungsindex und der Taschentiefe. Zudem besteht eine Korrelation zu anderen Entzündungsmarkern wie Interleukin-1 und Prostaglandin E2. Gesunde Patienten und Patienten mit leichter Gingivitis können an Hand des im Sulkusfluid gemessenen Calprotectins sicher von Patienten mit Parodontitis und aggressiver Parodontitis unterschieden werden. Diese Tatsache erlaubt sowohl eine frühzeitige Diagnostik als auch eine Prognoseabschätzung über das Calprotectin.
In Longitudinalstudien wurde gezeigt, dass Calprotectin in GCF nach nicht-chirurgischer Parodontitis-Therapie signifikant abfällt und der Abfall mit dem Rückgang der Taschentiefe korreliert.
Calprotectin ist, wie alle anderen Entzündungsmarker auch, nicht spezifisch für das Parodontalgewebe. Diagnostisch genutzt wird es schon seit geraumer Zeit in der Stuhlanalytik zur Beurteilung der Entzündungsaktivität der Darmschleimhaut bei entzündlichen Darmerkrankungen. Auch im Serum ist es bei entzündlichen Systemerkrankungen erhöht, z. B. bei Patienten mit Rheumatoidarthritis. Die hohe Wertigkeit von Calprotectin für die Zahnmedizin begründet sich durch die direkte Probennahme aus der Zahntasche, der Quelle der Entzündung. Daher kann unmittelbar auf die lokale Entzündungsaktivität geschlossen werden. Dass Granulozyten die Quelle des in GCF gemessenen Calprotectins sind, läßt sich damit beweisen, dass Calprotectin zur Granulozytenspezifischen Myeloperoxidase korreliert. Eine »Kontamination der Zahntasche« durch hohe Calprotectin-Serumspiegel ist auszuschließen, da die Spiegel in der GCF im Vergleich zum Serum um ein Vielfaches höher sind.
Auch unsere im Rahmen der Testvalidation gewonnen Daten belegen die Korrelation von Calprotectin mit der Taschentiefe und zahnärztlichen Befunden.
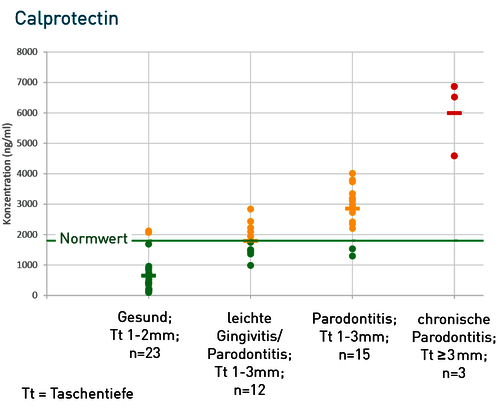
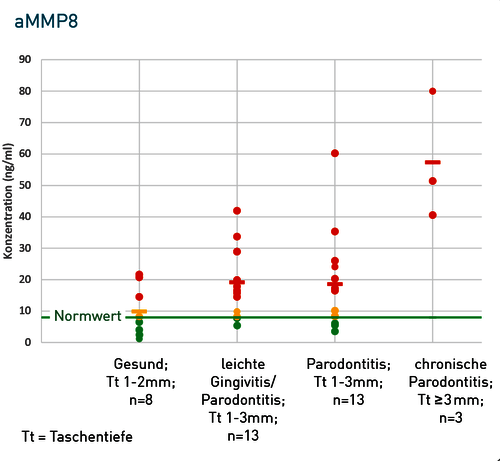
Abb. 2 Etablierungsstudie des Calprotectins im IMD-Berlin. Im Vergleich zum aMMP8 zeigte sich beim Calprotectin eine bessere Korrelation zur klinischen Gruppenzuordnung bei verbesserter Sensitivität und Spezifität. So zeigte sich beim aMMP8 in der Gruppe der Gesunden bei 3 von 8 Patienten ein (falsch) erhöhter Wert. In der Gruppe »Parodontitis -Taschentiefe > 3mm« waren mit dem Calprotectin alle Patienten über dem Entscheidungs-Grenzwert von 1000 ng/ml. Beim aMMP8 zeigten dagegen 3 von 13 Patienten einen Messwert unter der Nachweisgrenze (falsch negativ).
Granulozytäre Mediatoren wie das Calprotectin stehen am Beginn der Entzündungskaskade und induzieren erst die Freisetzung des aMMP8. Dies ist möglicherweise die Ursache für eine bessere Korrelation zwischen der Calprotectin-Konzentration und dem klinisch objektivierbaren Entzündungsprozess. Zudem sind die messbaren Spiegel an Calprotectin deutlich höher (siehe Skale der Y-Achse in Abbildung 2), was zu einer optimalen Messsicherheit und einer Verringerung des Sensitivitätsproblems im unteren Messbereich führt. Die bessere klinische Korrelation von Calprotectin im Vergleich zu aMMP8 könnte in Einzelfällen auch dadurch begründet sein, dass Raucher bei gleicher Lokalentzündung niedrigere aMMP8-Werte zeigen als Nichtraucher.
Für die Probenentnahme aus der Zahntasche werden spezielle vom Labor zur Verfügung gestellte Papierstreifen in die Zahntasche eingeführt und für ca. 30 Sekunden belassen. Auch aus Kostengründen empfiehlt sich bei Parodontitis eine Poolprobe aus Abnahmen verschiedener Stellen analysieren zu lassen. Bei Periimplantitis sind dagegen Einzelzahnanalysen sinnvoll.
Die mit Sulkusflüssigkeit vollgesogenen Streifen werden in einem Versandröhrchen mit der Post an das Labor geschickt. Calprotectin ist sehr lagerungsstabil und somit für die Laboranalytik auch bei längerem Probentransport unkompliziert.
Calprotectin Abnahme-Sets und vorfrankiertes Versandmaterial werden vom Labor kostenfrei zur Verfügung gestellt.
Die Bestimmung des Calprotectins im Sulkus ist im privatärztlichen Bereich abrechenbar. Die Bestimmung des Calprotectins gehört nicht zum Leistungsspektrum der gesetzlichen Krankenkassen (GKV).
Bitte entnehmen Sie die enstsprechenden Kosten auch für Selbstzahler dem PDF-Dokument.