Als Glykierung bezeichnet man die irreversible Reaktion von Proteinen, Lipiden und Nukleinsäuren mit Kohlenhydraten. Glykierte Reaktionsprodukte werden als Advanced Glycation Endproducts (AGEs) bezeichnet. Im Wesentlichen sind es Fruktose, Galaktose, aber auch Glukose, die unkontrolliert mit körpereigenen Strukturen reagieren. Biochemisch handelt es sich um den mehrstufigen Prozess der Maillard-Reaktion mit dem Zwischenschritt der Bildung Schiffscher Basen. Enzyme sind dabei nicht beteiligt, im Gegensatz zur Glykosilierung
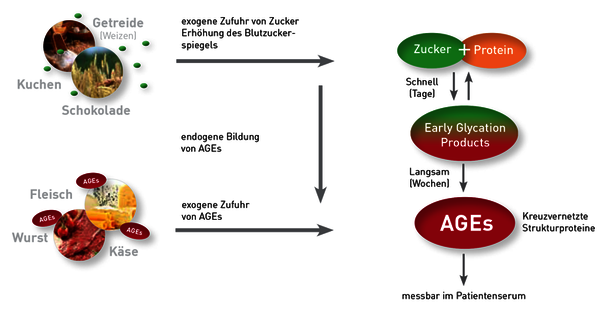
Es muss zwischen endogen gebildeten AGEs und exogen aufgenommenen AGEs unterschieden werden.
Durch endogene Bildung entstehen höhere Konzentrationen an AGEs im Serum, bedingt vor allem durch ein erhöhtes Angebot an Blutzucker. Die Lebensmittel, die den Blutzucker am stärksten erhöhen, zeigen auch die stärkste AGE-Bildung (transiente Hyperglykämien). Zum Beispiel wirkt Fruktose stärker AGE-bildend als Glukose [1]. Auch Getreide, insbesondere Weizen, ist als starker AGE-Bildner bekannt. Das Amylopectin A des Weizens wird durch die Amylase am schnellsten »verdaut«, was zu einem raschen Anstieg der Blutglukose führt. Unabhängig vom Angebot an glykierenden Zuckermolekülen wird die endogene AGE-Formation durch oxidativen Stress und chronische Entzündung deutlich gefördert [2].
AGEs können aber nicht nur endogen im Organismus entstehen, sondern auch schon über die Nahrung aufgenommen werden. Der AGE-Gehalt von Lebensmitteln ist sehr unterschiedlich. Fleisch, Wurst, Schinken aber auch Käse enthalten viel AGEs. Vor allem Grillen, Braten und Frittieren sowie langes Kochen können den AGE-Gehalt um ein Vielfaches erhöhen. Allgemein sind die Lebensmittel AGE-reicher, die viele gesättigte Fettsäuren enthalten.
Das HbA1c ist eines der endogen gebildeten Glykations-Produkte. Es gibt beim Diabetiker indirekt Auskunft über den Blutzuckerspiegel der letzten Wochen. Zur Beurteilung des Gesamt-Glykationsstoffwechsels ist allerdings das AGEs besser geeignet, da nur mit den AGEs auch die exogen aufgenommenen Glykationsprodukte mit erfasst werden und aus dem modifizierten Hämoglobin nicht unmittelbar auch auf die Glykierung von Proteinen und Nukleinsäuren geschlossen werden kann. Außerdem erfasst der AGE-Test nicht nur die Glukose-, sondern auch die Fruktose- und Galaktose-modifizierten Strukturen.
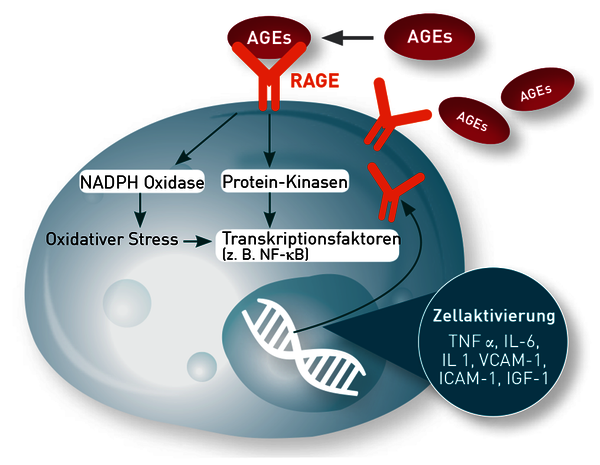
Die AGE sind an der Entwicklung verschiedener chronischer Entzündungserkrankungen beteiligt, z. B. Diabetes mellitus Typ II, Gefäß- und Herz-Kreislauferkrankungen [3], Osteoporose [4] und Arthritis [5]. Als ursächlich wird angesehen, dass die Glykierung einerseits die Funktionalität wichtiger Regulationsenzyme und Membransysteme stört, andererseits die AGEs selbst auch wichtige Stoffwechselprozesse beeinflussen. Durch Bindung an den AGE-Rezeptor (RAGE) auf Entzündungszellen induzieren sie NFkB und damit systemische Entzündung und oxidativen Stress. In Monozyten und Makrophagen wird dadurch die Ausschüttung von Interleukin-1, Interleukin-6, TNF-α und Insulin-like growth factor-1 (IGF-1) angeregt [6, 7]. Endothelzellen exprimieren Adhäsionsmoleküle wie VCAM-1 und ICAM-1, was zur endothelialen Inflammation führt. AGEs können auch die induzierbare NO-Synthase (iNOS) aktivieren und darüber den nitrosativen Stress fördern [8]. Alle genannten Mediatoren verstärken u.a. die Insulinresistenz, was wiederum die Blutzuckerspitzen verstärkt und einen gefährlichen Circulus vitiosus induziert. Die Aktivierung von NFkB steigert zudem die Zellexpression von RAGE, was die entzündungsfördernde Wirkung von AGEs zusätzlich verstärkt.

In Folge der Glykierung von Myelin der Neuronen werden Neuropathien gefördert, z. B. bei Diabetes mellitus, aber auch beim Morbus Alzheimer [9,10]. Nahrungsmittel und Getränke, die hohe AGE-Konzentrationen enthalten, können auch akut die Blutgefäßfunktion beeinträchtigen, wobei hier der langfristig schädigende Effekt im Vordergrund steht [11]. Die breit angelegten negativen Effekte auf den Stoffwechsel sind aber vor allem dadurch zu erklären, dass zahlreiche, v. a. kurzlebige Substanzen wie Lipide, Aminosäuren, Enzyme, Hormone (z. B. Insulin) oder Wachstumsfaktoren strukturell und funktionell durch die Glykierung geschädigt werden.
Eine Senkung der AGE-Spiegel im Blut ist über alle Maß- nahmen möglich, welche einerseits die Hyperglykämie senken sowie andererseits den oxidativen Stress und die chronische Entzündung reduzieren. Zielführend ist in jedem Fall eine Umstellung der Ernährung. Insofern dient die Kenntnis des AGE-Spiegels auch der Motivation des Patienten zur Ernährungsumstellung. Neben Fleisch, Wurst, Schinken und Käse sowie allen Nahrungsmitteln mit hohem glykämischen Index wird auch dem Weizen und anderen Getreiden eine hohe Bedeutung beigemessen, da die Aufnahme von Getreideprodukten (auch Vollkornprodukten) den Blutzuckerspiegel deutlich ansteigen lassen (siehe Musterbefund). .
1 ml Serum
Ein Probeneingang im Labor innerhalb von 24 Stunden (24h) muss gewährleistet sein. Das Blut sollte bei Raumtemperatur gelagert und transportiert werden. Bitte nutzen Sie unseren Berliner Fahrdienst oder unseren kostenfreien bundesweiten Kurierdienst.
Eine Abrechnung ist nur im privatärztlichen Bereich (GOÄ) gegeben. Die aktuellen Untersuchungskosten für Selbstzahler (IGeL) entnehmen Sie bitte dem PDF Dokument.
Zu diesem Thema steht Ihnen in unserem Videoarchiv ein Übersichtsvortrag zur Verfügung. Der Zugang ist ohne Anmeldung und kostenfrei möglich.
[1] Sakai M, Experimental studies on the role of fructose in the development of diabetic complications. Kobe J Med Sci. 2002; 48:125-36.
[2] Schiekofer S. et al.: Acute hyperglycemia causes intracellular formation of CML and activation of ras, p42/44 MAPK, and nuclear factor kappaB in PBMCs. Diabetes 52, 2003, S. 621–633
[3] Koschinsky T, et. al. An environmental risk factor in diabetic nephropathy. PNAS 94, 1997, S. 6474–6479
[4] Sanguineti R. et al.: Advanced Glycation End Products Play Adverse Proinflammatory Activities in Osteoporosis. Mediators of inflammation 2014, 2014, S. 975872
[5] Vlassara H et al. Recent progress in advanced glycation and diabe tic vascular disease: role of advanced glycation end product receptors. Diabetes 1996; 45: 65-66
[6] Chuah et al.: Receptor for Advanced Glycation End Products and Its In volvement in Inflammatory Diseases. Int J Inflammation 2013, 2013, S. 403460
[7] Ott C. et al. Role of advanced glycation end products in cellular signaling. Redox biology 2, 2014, S. 411–429
[8] Wewer RM Arteriosclerosis and the two faces of endothelial nitric oxide synthetase Circulation 1998; 97: 108-112
[9] Singh V. P. et al.: Advanced Glycation End Products and Diabetic Complications. Korean Journal of Physiology & Pharmacology 18, 2014, S. 1–14
[10] Angeloni C. Role of Methylglyoxal in Alzheimer‘s Disease. BioMed Res Int 2014 S. 238485
[11] Uribarri J et al. Single oral challenge by advanced glycation end products acutely impairs endothelial function in diabetic and nondiabetic subjects. Diabetes Care. 2007;30:2579-82