Chemotherapeutika in der Tumortherapie wirken nicht bei jedem Patienten gleich. Ursächlich für die Variabilität der Medikamentenwirkung sind unsere Erbanlagen, die die pharmakokinetischen und pharmakodynamischen Prozesse eines Arzneimittels beeinflussen.
Genetisch bedingte Varianzen der Enzymaktivität gehen mit unterschiedlich schnellem Abbau der Arzneimittel einher. Als Folge können bei Patienten mit verlangsamtem Arzneimittelmetabolismus unter Standarddosierung des Arzneimittels schwere bis lebensbedrohliche Nebenwirkungen auftreten.
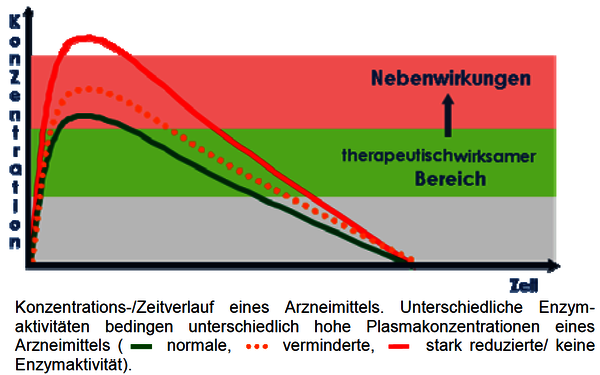
Ziel der Pharmakogenetik ist es, durch Untersuchung von entsprechenden Genvarianten, Voraussagen über die Wirksamkeit und Verträglichkeit von Arzneimitteln machen zu können. Dieses Vorgehen ermöglicht eine individualisierte Pharmakotherapie.
Wir weisen darauf hin, dass bei Therapiebeginn trotz prätherapeutischer Testung auf Genvarianten, die in den Fachinformationen empfohlenen Sicherheitsmaßnahmen und Untersuchungen zu beachten sind.
Thiopurine (Azathioprin, 6-Mercaptopurin, 6-Thioguanin) werden als Zytostatika und Immunsuppressiva eingesetzt. Substanzen dieser Gruppe metabolisiert das Enzym Thiopurin-S-Methyltransferase (TPMT). Genvarianten im TPMT-Gen (TPMT*2/*3A-C) sind mit herabgesetzter bzw. fehlender Enzymaktivität assoziiert, wodurch der Abbau der Wirkstoffe eingeschränkt ist. Rund 0,3% der Europäer sind homozygote bzw. 10% heterozygote Träger von zwei bzw. einem TPMT-Mangelallel (=komplette bzw. partielle TPMT-Defizienz). Eine komplette TPMT-Defizienz geht unter Standard-dosierung fast immer mit schweren unerwarteten hämatologischen Nebenwirkungen einher, so dass bei diesen Patienten eine Thiopurin-Therapie kontraindiziert ist oder nur bei erheb-licher Dosisreduzierung erfolgen darf. Auch bei partieller TPMT-Defizienz ist das Risiko für Nebenwirkungen infolge der Einnahme thiopurin-haltiger Arzneimittel erhöht und es sollte eine Dosisanpassung erfolgen.
Die Uridin-Diphosphat-Glucuronosyltransferase 1A1 (UGT1A1) ist entscheidend am Abbau von Irinotecan, einem Zytostatikum zur Darmkrebs-behandlung, beteiligt. Durch Glukuronidierung wird der zytotoxisch wirksame aktive Metabolit von Irinotecan (SN38) in den inaktiven Metaboliten (SN38G) umgewandelt und so ausgeschieden. Bei Vorliegen einer genetischen Variante (UGT1A1*28-Allel) ist die Synthese des Enzyms auf ca. 30% des Normwertes gesenkt, wodurch die Entgiftungsleistung für Irinotecan stark reduziert wird. Bereits heterozygote Träger des UGT1A1*28-Allels sind gefährdet unter Standard-dosierung unerwartete toxische Nebenwirkungen zu entwickeln. Etwa 11% der Europäer sind homozygote und 55% sind heterozygote Träger des UGT1A1*28-Allels.
Das Zytostatikum und Immunsuppressivum Methotrexat (MTX) greift in den Folsäurestoffwechsel ein und agiert hier besonders mit dem Enzym Methylentetrahydrofolat-Reduktase (MTHFR). Zwei genetische Varianten (C677T und A1298C) im MTHFR-Gen führen zu einem Enzym mit herabgesetzter Aktivität, woraus ein erhöhtes Risiko für unerwartete toxische Nebenwirkungen unter Methotrexat-Therapie resultiert. Bei Patienten, welche homozygot bzw. heterozygot für die genetische Variante C677T sind (ca. 10% bzw. 40% der Europäer), beträgt die Restaktivität des Enzyms nur 35-60%.
Bei der Chemotherapie mit 5-Fluorouracil (5-FU) bzw. seiner Vorstufen Capecitabin oder Tegafur ist die Funktionalität der Dihydropyrimidin-Dehydrogenase (DPYD) als wichtigstes Abbauenzym von entscheidender Bedeutung. Rund 80% des verabreichten 5-FU wird durch DPYD abgebaut. Bei Patienten mit DPYD-Mangel ist der Abbau gestört, so dass die Konzentration unter Standarddosierung bis in den toxischen Bereich ansteigen kann. Für das DPYD-Gen sind eine Reihe von Genvarianten beschrieben, die zu einer veränderten DPYD-Enzymaktivität führen. Die häufigste Ursache (~40%) für eine reduzierte bzw. fehlende Enzymaktivität ist eine Punkt-mutation, die ein Exonskipping verursacht (Exon 14-Skipping-Mutation; DPYD*2A-Allel). Etwa 1 bis 3% der Europäer sind heterozygote (=partielle DPYD-Defizienz) bzw. 0,01% homozygote Träger (=komplette DPYD-Defizienz) dieser Mutation. Bei einer kompletten DPYD-Defizienz ist die 5-FU-Therapie kontraindiziert. Eine partielle DPYD-Defizienz bedingt eine Dosisanpassung sowie eine Therapiekontrolle.
Das Cytochrom P450 2C8 (CYP2C8)-Enzym ist am Metabolismus des Zytostatikums Paclitaxel sowie weiterer Arzneimittel, wie z. B. von Statinen (Simvastatin, Fluvastatin) und Anal-getika (Diclofenac, Ibuprofen, Paracetamol) beteiligt. Die häufigste genetische Variante in der europäischen Bevölkerung CYP2C8*3 ist mit einer reduzierten Aktivität des Enzyms assoziiert. Bei Vorliegen dieses Allels ist die Umsatzrate von Paclitaxel auf ca. 15% im Vergleich zum Normwert verringert. Als Folge des verzögerten Abbaus können unter Standarddosierung verstärkt unerwünschte Nebenwirkungen auf-treten. Rund 13% der Europäer sind heterozygote und 1,7% homozygote Träger des CYP2C8*3-Allels.
Eine Abrechnung im kassen- und privatärztlichen Bereich ist gegeben. Genetische Unter-suchungen berühren nicht das Laborbudget.
Dr. med. Thomas Rasenack | 030 77 001-131 | |
M.Sc. Mandy Koch | 030 77 001-138 |