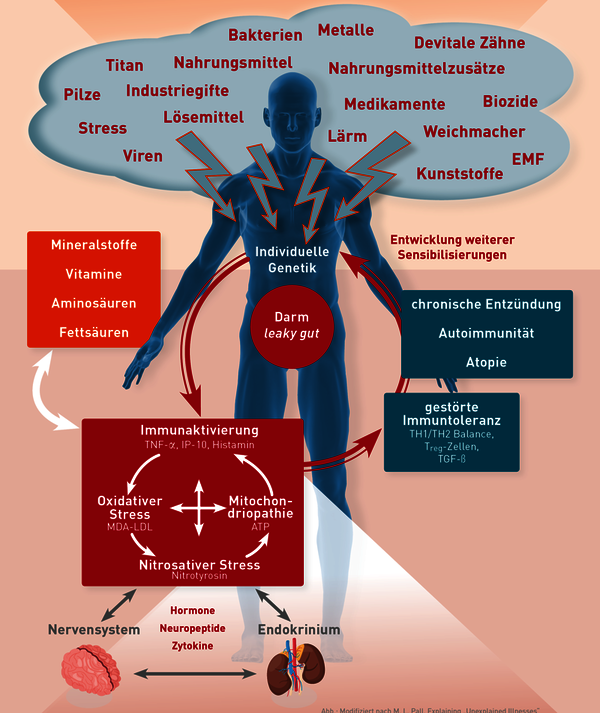
Insbesondere Martin L. Pall, Professor für Biochemie an der Washington State University, ist die Erkenntnis zu verdanken, dass immunologische und biochemische Entzündungsphänomene zentraler Bestandteil von Multisystemerkrankungen sind. Die zentralen Elemente der silent inflammation im Rahmen von Multisystemerkrankungen sind: die andauernde Aktivierung von Entzündungszellen, nitrosativer Stress, oxidativer Stress und die erworbene Mitochondriopathie. Die von Martin Pall geprägte und mit dem Fokus auf die Immunologie modifizierte Abb. 1 zeigt, dass diese vier Elemente der Multisystemerkrankung einen Circulus vitiosus darstellen, d. h. sich gegenseitig verstärken. Insofern ist es nicht verwunderlich, dass bei Betrachtung der Laborergebnisse von Patienten häufig mehrere oder sogar alle vier Regulationskompartimente betroffen sind.
Der offenkundigste Zusammenhang besteht dabei zwischen der Mitochondriopathie und der systemischen Entzündung. Dieses bedingt die oft anzutreffende Laborwertkonstellation, dass ein Abfall des intrazellulären ATP mit erhöhten Entzündungsmarkern im Blut (TNF-α oder IP-10) vergesellschaftet ist. Dass es dabei Ausnahmen gibt und dass jedes der Kompartimente vor allem in der Frühphase einer Erkrankung auch isoliert betroffen sein kann, ist durch unsere individuelle genetische Ausstattung und durch das sich unterscheidende Muster an einwirkenden Triggerfaktoren zu erklären.
Insbesondere Martin L. Pall, Professor für Biochemie an der Washington State University, ist die Erkenntnis zu verdanken, dass immunologische und biochemische Entzündungsphänomene zentraler Bestandteil von Multisystemerkrankungen sind. Die zentralen Elemente der Multisystemerkrankung sind: nitrosativer Stress, oxidativer Stress, die erworbene Mitochondriopathie und die Entzündung (Inflammation). Die von Martin Pall geprägte und hier mit dem Fokus auf die Immunologie modifizierte Abbildung 1 zeigt, dass diese vier Elemente der Multisystemerkrankung einen Circulus vitiosus darstellen, d.h. sich gegenseitig bedingen und verstärken. Insofern ist es nicht verwunderlich, dass bei Betrachtung der Laborergebnisse von Patienten häufig mehrere oder sogar alle vier Regulationskompartimente betroffen sind.
Der offenkundigste Zusammenhang ist dabei der zwischen der Mitochondriopathie und der systemischen Entzündung. Dieses bedingt die oft anzutreffende Laborwertkonstellation, dass ein Abfall des intrazellulären ATP mit erhöhten Entzündungsmarkern im Blut (TNF-α oder IP-10) vergesellschaftet ist. Warum es dabei Ausnahmen gibt und warum jedes der Kompartimente vor allem in der Frühphase einer Erkrankung auch isoliert betroffen sein kann, ist sehr wahrscheinlich durch unsere individuelle genetische Ausstattung und durch das sich unterscheidende Muster an einwirkenden Triggerfaktoren zu erklären.
Infektionserreger wie Borrelien, Chlamydien, Herpesviren und Pilze aktivieren primär die Entzündungszellen. Der nitrosative und oxidative Stress sowie die Mitochondriopathie sind bei Infektionen eher die sekundäre Folge. Schadstoffe wie z. B. Metalle, Acrylate oder Lösemittel können dagegen über zwei Wege als Triggerfaktor manifest werden.
Zum einen primär über die Aktivierung von Immunzellen, insbesondere wenn individuelle allergische Sensibilisierungen vorliegen, oder aber dosisabhängig über toxikologische Einflüsse. Da letztere meist mit Störungen zellulärer Enzym- und Regulationsfunktionen einhergehen, ist bei toxikologischen Schadstoffeffekten oft initial der oxidative oder nitrosative Stress und die Mitochondrienfunktion gestört und die Immunaktivierungsmarker (noch) im Normbereich.
Zusammenfassend ist zu sagen, dass sich aus dem Muster der vier Kompartimentsmarker zumindest in einigen Fällen differentialdiagnostische Schlüsse über die individuell verantwortlichen Triggerfaktoren ableiten lassen. Das dieses nicht in jedem Fall gelingt, liegt daran, dass in der chronifizierten Phase nicht selten mehrere oder alle Kompartimente betroffen sind, dass die Kompartimente individuell verschieden empfindlich reagieren und dass wir es in der Praxis häufig mit Mehrfachbelastungen, d. h. multiplen Triggerfaktoren zu tun haben.
In der Abb. 1 ist dargestellt, dass die chronische Entzündung die Fähigkeit unseres zellulären Immunsystems zur Erhaltung einer Immuntoleranz stört. So erklärt sich, dass in Folge chronisch systemischer Entzündungen Trigger als Stimulus relevant werden können, die bis dahin toleriert wurden und keine Immunaktivierung induziert haben.
TNF-α ist ein Zytokin, das hauptsächlich von Makrophagen sezerniert wird. Als proentzündliches Schlüsselzytokin wird es bezeichnet, weil es am Beginn der NFkB-assoziierten Entzündungskaskade TNF-α → IL1 → IL6 → IL10 → IL1RA → CRP steht. Diese prominente Stellung macht es zum sensitivsten Markerzytokin für die myelomonozytäre Entzündung.
Interferon-gamma-induced protein 10 wird von Makrophagen nach Stimulation durch IFN-γ ins Blut abgegeben. Da IP-10 fast ausschließlich durch IFN-γ induziert wird und selbst in deutlich höheren Spiegeln im Blut zirkuliert als die Interferone selbst, ist dieses Chemokin ein idealer Biomarker, um die biologische Aktivität des IFN-γ und die TH1- zelluläre Immunaktivierung zu quantifizieren.
Histamin ist ein von Mastzellen produziertes Gewebshormon. Entgegen der üblichen Vorstellung spielen Mastzellen und Histamin nicht nur im Rahmen der Typ I-Allergie eine Rolle, sondern bei nahezu jeder Immunreaktion auf externe Antigene und Allergene sowie sogar auf Stress. Histamin wirkt über vier verschiedene Rezeptortypen (HR1-HR4) auf diverse Organe wie Magen, Lunge, Gefäße, Gehirn oder Darm und stimuliert über Histamin-Rezeptoren auf Leukozyten zahlreiche Entzündungsphänomene. Die Analyse erfolgt im Heparin-Vollblut, nicht im Serum, weil hier die Stabilität zu gering ist.
ATP wird über die Atmungskette in Mitochondrien produziert. Der in Leukozyten bestimmte ATP-Spiegel ist somit ein Surrogatmarker für die aktuelle Mitochondrienfunktion. Verminderungen zeigen sehr sensitiv eine erworbene Mitochondriopathie an. MDA-LDL → oxidativer Stress Malondialdehyd-modifiziertes LDL (MDA-LDL) ist eine oxidierte Form des LDL-Cholesterins, die durch Reaktion der Lipide mit Sauerstoffradikalen entsteht (Lipidperoxidation). MDA-LDL ist somit ein Biomarker des oxidativen Stress und deshalb, sowie wegen der längeren Serum-Halbwertszeit, besser geeignet zur Beurteilung der oxidativen Belastung als bisher verwendete prooxidative Stoffwechselmarker wie z. B. Malondialdehyd selbst oder Enzymaktivitäten wie die der Glutathion-S-Tranferase oder Glutathionperoxidase.
Tyrosin ist eine Aminosäure im Blut. Nitrotyrosin entsteht im Organismus durch Bindung von reaktiven Stickstoffspezies an das Tyrosin (Nitrilierung). Da diese »Umwandlung« zum Ausmaß der Belastung mit reaktiven Stickstoffspezies korreliert, stellt der Nitrotyrosinspiegel den derzeit stabilsten Biomarker des nitrosativen Stress dar (sensitiver als Citrullin im Urin). Der Bezug auf den Gesamtgehalt an Tyrosin im Blut ist nicht notwendig, da die Nitrilierung linearen Konzentrationsverhältnissen folgt. Eine Quotientenbildung kann vor allem bei hohen Tyrosinwerten den nitrosativen Stress sogar unterbewerten.
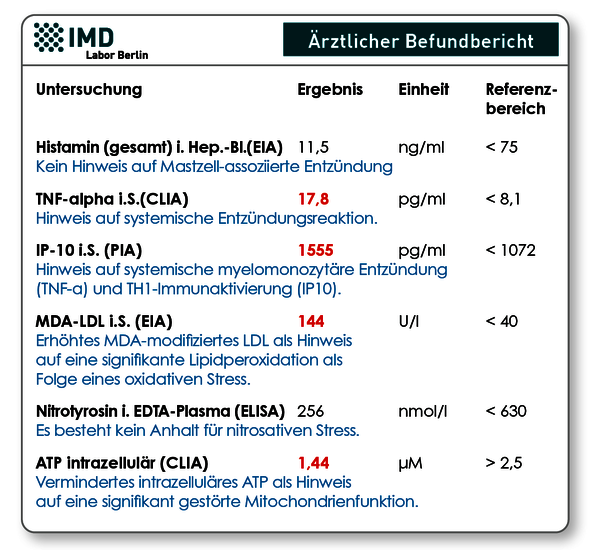
Die komplexe Betrachtung der sechs erhobenen Labormarker erlaubt:
1. die Statusanalyse der vier Regulationskompartimente zur Erkennung der chronisch entzündlichen Multisystemerkrankung, zur optimalen Planung einer substituierenden Therapie (antientzündlich?, antioxidativ?) und zur Verlaufskontrolle
2. die Differentialdiagnostik der individuell verantwortlichen Triggerfaktoren, zumindest um in Verbindung mit der Anamnese die notwendige Folgediagnostik (LTT, Infektionsdiagnostik, Allergiediagnostik, Toxikologie etc.) kostenbewusst eingrenzen zu können
2x 10 ml Heparin-Blut + 5 ml Serum + 2,6 ml EDTA-Blut
Eine Abrechnung ist nur im privatärztlichen Bereich (GOÄ) gegeben. Die aktuellen Untersuchungskosten für Selbstzahler (IGeL) entnehmen Sie bitte dem PDF Dokument.